المحتويات
الفرق بين الكاتيون والأنيون – 2022
توقع الكاتيونات و الأنيونات
في بعض الأحيان ، يمكنك التنبؤ بما إذا كانت الذرة ستشكل كاتيونات أو أيونات على أساس موقعها على الجدول الدوري. المعادن القلوية والأتربة القلوية تشكل دائما الكاتيونات. الهالوجينات دائما تشكل الأنيونات. معظم اللافلزات الأخرى تشكل عادة الأنيونات (مثل الأكسجين والنيتروجين والكبريت) ، في حين أن معظم المعادن تشكل الكاتيونات (مثل الحديد والذهب والزئبق).
الأَيُون (أو الشاردة) ) هو نوع كيميائي (ذرّة أو جزيء) مشحون كهربائياً. يمكن التمييز بين الأيونات السالبة وبين الأيونات الموجبة. على العموم تتعلق الشحنة بعدد الإلكترونات؛ إذا كان عدد الإلكترونات في النوع الكيميائي أكثر من عددها في الحالة المعتدلة فالشحنة تكون سالبة؛ وإذا كان عدد الإلكترونات في النوع الكيميائي أقل من عددها في الحالة المعتدلة فالشحنة تكون موجبة.
الأيونات السالبة والموجبة
- بالنسبة للذرات فالأيون الموجب هو ذرة أو جزيء يفوق عدد بروتوناتها عدد الإلكترونات، أي تفوق الشحنة الموجبة في الذرة الشحنة السالبة. يتكون الأيون الموجب إثر خسارة الذرة للإلكترونات (مقدار الشحنة الموجبة التي تأخذها الذرة يتعلق بعدد الإلكترونات التي تخسرها). فمثلاً، إذا خسرت الذرة إلكترونًا واحدًا بعد أن كانت حيادية (متعادلة، أي عدد الإلكترونات = عدد البروتونات) فعدد البروتونات يصبح فيها أكبر من عدد الإلكترونات بوحدة واحدة أي أن الذرة تشحن بشحنة موجبة (+1).
- بالنسبة للذرات فالأيون السالب هو ذرة يفوق إلكتروناتها عدد البروتونات، أي تغلب الشحنة السالبة في الذرة الشحنة الموجبة. مقدار الشحنة السالبة للذرة يتعلق بعدد الإلكترونات التي تكتسبها الذرة، فمثلاً إذا اكتسبت الذرة إلكترونا واحدا، فعدد الإلكترونات يصبح فيها أكبر بوحدة واحدة من عدد البروتونات. وبما أن شحنة الإلكترون سالبة، إذن تشحن الذرة بشحنة (-1).
تاريخ الاكتشاف
كلمة أيون هي اليونانية ιον (الذهاب)، النعت الحالي ιεναι، ienai، “للذهاب”. وقدم هذا المصطلح من قبل الفيزيائي الإنجليزي والكيميائي مايكل فاراداي في عام 1834 لهذه الأنواع غير المعروفة في ذلك الوقت التي تذهب’ من قطب إلى آخر من خلال وسط مائي.
تكون الأيونات

عند ذوبان ملح الطعام (كلوريد الصوديوم) في الماء يتفكك الجزيء إلى أيون صوديوم موجب الشحنة وأيون كلور سالب الشحنة.
تتكون الأيونات من ذرات عندما تفقد إلكترونات أو تكتسب إلكترونات. ورغم أن تفكك الجزيء يحتاج إلى طاقة من الخارج إلا أن تكوّن الأيونات قد تكون أنسب من وجهة اكتمال الغلاف الإلكتروني الخارجي للذرة أو الأيون. تحاول الأيونات بصفة عامة الوصول إلى ما يسمى قاعدة الثمانيات.
الكاتيونات (الأيونات الموجبة)
الأيونات الموجبة الشحنة تسمى كاتيونات. ويتكون الكاتيون عندما تفقد ذرة إلكترونات. ونظرا لأن النواة الذرية تحتفظ بعدد البروتونات فيها (في الذرة المتعادلة تتساوى فيها عدد البروتونات وعدد الإلكترونات) ، ولذلك يظهر الأيون بأن له شحنة موجبة.
أمثلة:
تكون أيون الصوديوم: Na → Na+ + e
تكون أيون المغنسيوم: Mg → Mg2+ + 2e
تكون أيون ألومنيوم: Al → Al3+ + 3e
تكون أيون قصدير: Sn → Sn4+ + 4e
بصفة عامة تكوّن الفلزات كاتيونات (أيونات موجبة).
الهَابِطَة أو الشاردة الهابطةأو الدالف المَهْبَطِيّ أو الكَاتْيُون نقحرة من (بالإنجليزية: cation) هي شاردة موجب الشحنة. الدوالف الموجبة الشحنة تسمى هوابط أو كاتيونات. وتتكون الشاردة الهابطة عندما تفقد ذرة إلكترونات. ونظرا لأن النواة الذرية تحتفظ بعدد البروتونات فيها (في الذرة المتعادلة تتساوى فيها عدد البروتونات وعدد الإلكترونات)، ولذلك تظهر الشاردة بأن لها شحنة موجبة.
الأنيونات (الأيونات السالبة)
تسمى الأيونات سالبة الشحنة أنيونات، ويتكون الأنيون عندما تكتسب الذرة إلكترونا. بذلك يصبح للذرة شحنة زائدة من الإلكترونات، فتكون سالبة الشحنة.
مثال : اللافلزات – تكون أيونات سالبة الشحنة.
معادلة تكوّن أيون الكلور: Cl + e− → Cl
معادلة تكوّن أيون السلفيد : S + 2e− → S−2
ملحوظة: نظرا لتعثر نقل الصيغة الإنجليزية (من اليسار إلى اليمين) إلى الصيغة العربية (من اليمين إلى اليسار) فقد تعذر وضع العلامة السالبة على أيون الكلور، في المعادلة إلى اليمين. ولكن مثال السلفيد يوضح ذلك، وقد اكتسب شحنتين سالبتين (أي اكتسب إلكترونين).
تتكون الأيونات عند إذابة أملاح في سوائل مثل الماء، فهي تتفكك.
مثال تفكك كلوريد الصوديوم (ملح الطعام):
- {\displaystyle \mathrm {{NaCl_{(s)}}{\longrightarrow }{Na_{(aq)}^{+}}+{Cl_{(aq)}^{-}}} }
جزيء كلوريد الصوديوم يكون متعادلا كهربائيا في العادة، ولكن عند إذابته في الماء يتفكك بحيث يأخذ الكلور إلكترونا من الصوديوم ويصبح سالبا الشحنة، ونظرا لأن ذرة الصوديوم فقدت إلكترونا فتصبح موجبة الشحنة (أي تصبح كاتيون).
الرمز „aq“ يعني “في سائل” aqua ، وأما الرمز „s“ المكتوب بجانب كلوريد الصوديوم فمعناه “صلب” solid.
الصَاعِدَة أو الشاردة الصاعدة أو الدالف المَصْعَدِيأو الأَنْيُون نقحرة من (بالإنجليزية: anion) هي شاردة سالب الشحنة. تسمى الشاردات سالبة الشحنة شاردات صاعدة، وتتكون الصاعدة عندما تكتسب الذرة إلكترونا. بذلك يصبح للذرة شحنة زائدة من الإلكترونات، فتكون سالبة الشحنة.
أمثلة
اللافلزات – تكون شاردات سالبة الشحنة.
معادلة تكوّن شاردة الكلور: Cl + e− → Cl
معادلة تكوّن شاردة السلفيد : S + 2e− → S−2
ملحوظة: نظرا لتعثر نقل الصيغة الإنجليزية (من اليسار إلى اليمين) إلى الصيغة العربية (من اليمين إلى اليسار) فقد تعذر وضع العلامة السالبة على شاردة الكلور، في المعادلة إلى اليمين. ولكن مثال السلفيد يوضح ذلك، وقد اكتسب شحنتين سالبتين (أي اكتسب إلكترونين).
تتكون الأيونات عند إذابة أملاح في سوائل مثل الماء، فهي تتفكك.
مثال تفكك كلوريد الصوديوم (ملح الطعام): جزيء كلوريد الصوديوم يكون متعادلا كهربائيا في العادة، ولكن عند إذابته في الماء يتفكك بحيث يأخذ الكلور إلكترونا من الصوديوم ويصبح سالبا الشحنة، ونظرا لأن ذرة الصوديوم فقدت إلكترونا فتصبح موجبة الشحنة (أي تصبح كاتيون).
الرمز “aq” يعني «في سائل» aqua ، وأما الرمز “s” المكتوب بجانب كلوريد الصوديوم فمعناه «صلب» solid.
سلوك الأنيونات في المياه الشعرية
في التربة أو الصخور المسامية، تغير الأنيونات في المياه الشعرية سلوكها. لا تصف نظريات التشتت الحراري التقليدية للمواد المذابة في التربة، المستخدمة حتى التسعينيات، السلوك الحقيقي للأنيونات في التربة.
في مياه التربة، أو في المياه الجوفية على سبيل المثال الموجودة في الطباشير، لوحظ منذ عدة عقود أن متوسط سرعة نقل الأنيونات الذائبة في الماء يمكن أن يكون أكبر بكثير من جزيئات الماء المصاحب. تُعرف هذه الظاهرة أيضًا باسم استبعاد الأنيون. يُعزى إلى التنافر الإلكتروستاتيكي الناجم عن الشحنة السالبة للأسطح الصلبة؛ تدفع هذه القوة الأنيونات إلى مراكز مسام المادة حيث تكون سرعتها أسرع. وصفته نظرية تسمى ” نظرية الطبقة المزدوجة المنتشرة “. وهكذا فقد تبين تجريبياً (1990/1991) (في التربة الساحلية المروية) أن أيونات الكلوريد والكبريتات تدور في التربة أسرع مرتين من سرعة دوران الماء (هنا يتم تمييزها إشعاعيًا بالتريتيوم) حيث يتم إذابتها.، وحوالي 30 مرة أسرع في كل أو جزء من الصخور المسامية خلال هذه الدراسة (أكثر بكثير من القيم التي تنبأت بها النماذج القديمة للانتشار الجزيئي في وسط مسامي). وبالتالي يمكن أن يتعارض استبعاد الأنيون مع النماذج التي تعتمد فقط على الديناميكا المائية وتركيز المحلول وسرعة التدفق. هذه ظاهرة يجب أن تؤخذ في الاعتبار في حالة التربة التي تفقد الأنيونات أو عرضة للتملح.
الصيغة الكيميائية
تعطي شحنة الأيون عدد الشحنات السالبة أو الموجبة التي يمتلكها الأيون. وتـُكتب الشحنة فوق رمز العنصر.

أيون معقد Tetrafluorborate . تكتب الشحنة على القوس.
يكتب أيون مركب معقد بين قوسين قائمين وتكتب الشحنة على القوس، كالشكل المبين لأيون تترافلوروبورات :
خواص الأيونات
يعتمد قطر الأيون على قطر الذرة الناشئ منها أو يعتمد كذلك على جزيء المركب المتعادل كهربائيا. أصفوعلى وجه العموم تكون الكاتيونات أصغر من الأنيونات حيث يفقد الكاتيون إلكترونا أو إلكترونات المدار الخارجي للذرة. هذا يجعل الأنيونات أكبر حيث تتكون لها مدارات فوقية جديدة.

شكل توضيحي لجهد كهروستاتيكي لأيون النيترات (NO3−). المناطق الملونة بالأحمر أقل طاقة من الملونة بالأصفر
كما تختلف استقطابية شحنة الجزيء (أي توزيع الشحنة عليه) بحسب قطر الأيون وشكله، فقد يكون بيضيا أو مستطيلا أو كرويا.
تكوّن الأيونات ذات الشحنة المتضادة رابطات أيونية مكونة أملاحا. وتوصل محاليل الأملاح الأيونية التيار الكهربائي وهي لذلك تسمى تلك المحاليل كهارل electrolyte . ويعود السبب في توصيل التيار الكهربائي إلى الحركة الانتقالية للأيونات في وجود مجال كهربائية أو مجال مغناطيسي في محلول الكهرل أو خارجه. يرمز إلى حركية الأيونات أو قدرتها على الحركة في مجال كهربائي بالرمز {\displaystyle \mu }
وجودها واستخداماتها
الأيونات هي أساس عمل البطاريات وبطارية السيارة والخلية الضوئية. كما تلعب الكهارل دورا أساسيا في التمثيل الغذائي في جسم الإنسان وجميع الكائنات الحية ومن ضمنها النباتات.
وتستخدم في طلاء المعادن بالجلفنة وتنقية المعادن من الشوائب واستخراج الألمونيوم.
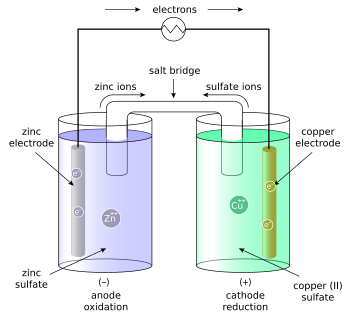
خلية جلفانية (خلية دانيال) ويلاحظ وجود الأيونات في المحلولين وانتقالهم عبر القنطرة وبذلك تتم الدورة الكهربائية بين لوح الخارصين Zn ولوح النحاس Cu.
وتستخدم الأيونات في الفيزياء لإجراء بعض التجارب مثلما في مصدر أيوني، ونجدها طبيعيا في ريح شمسية التي تأتي إلى الأرض، وفي الأضواء القطبية وفي البرق ، وعندما تتحد الأيونات المختلفة الشحنة ببعضها البعض تصدر أحيانا ضوءا مثلما عند احتكاك الشهب في الغلاف لتقاء .
كذلك يتم إصدار الضوء في لمبات الخلخلة الكهربائية. ويسمى الغاز المحتوي على أغلبية من الأيونات بلازما.
يمكن لأيونات الغازات الخاملة الترابط مع بعضها وتكوين رابطة أيونية. أمثال تلك الغازات الهيليوم والنيون والكريبتون. كما تستخدم مركبات الهالوجينيات في توليد وصناعة الليزر ، مثلما في ليزر إكسيمر وهو يشبه في عمله ليزر ثاني أكسيد الكربون.
الأيونات الشائعة
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
